诊断病理学家带你了解尿路上皮癌的免疫治疗
抑制性检查点蛋白如程序性细胞死亡受体-1(PD-1),程序性细胞死亡配体-1(PD-L1)或细胞毒性T淋巴细胞相关蛋白-4(CTLA-4)抑制抗肿瘤T细胞反应。这几种检查点蛋白的增强是包括尿路上皮癌(UC)在内的几种实体瘤常见的免疫逃避策略。
免疫检查点阻断复合物会干扰肿瘤的免疫逃避策略。以PD-1和PD-L1为靶点的几种免疫治疗药物正逐渐成为治疗UC的首选药物。其中一些药物已经被美国食品和药品管理局(FDA)和欧洲药品管理局(EMA)批准用于治疗晚期或转移性UC。
最近发表在《Expert Opinion On Biological Therapy》上的一篇综述文章[1]对UC的免疫疗法选择进行了全面更新。更新总结如下:
1、免疫检查点抑制剂作为一种单一疗法,可有效治疗晚期UC患者(包括一线治疗中不符合含铂化疗条件的,或先前接受过含铂化疗的)。
2、目前正在等待免疫检查点抑制剂和化疗联合一线治疗的疗效试验结果。
3、尚不清楚这个组合是否能成为晚期UC的一线标准疗法。
尽管膀胱内卡介苗芽孢杆菌(BCG)免疫疗法是非手术治疗非肌层浸润性膀胱癌的金标准,但仍有40%的患者免疫治疗失败。Balar等人报道了帕博利珠单抗(pembrolizumab)在高危BCG无应答非肌层浸润性膀胱癌患者中的抗肿瘤活性结果。[2]
UC原本不需要进行PD-L1检测。FDA和EMA最近限制了抗PD-1 / PD-L1药物Keytruda(Pembrolizumab)和阿特珠单抗(Tecentriq,Atezolizumab)的使用:即这两种药物仅作为治疗局部进展或转移性UC成年患者的单一疗法,含铂化疗及免疫组化(IHC)PD-L1阳性患者不适合使用。
现在,UC患者需要进行PD-L1 IHC检测。目前有三种市售的PD-L1检测方法(Ventana SP263,Ventana SP142和Dako / Agilent 22C3),每种检测方法都有相应制造商的特定算法。(见图1,表1)
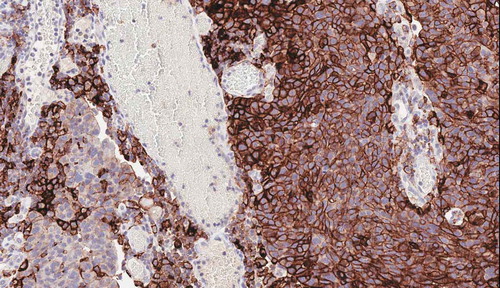
图1.PD-L1在高级别浸润性尿路上皮癌中的表达。
上皮细胞中可见强而弥漫性膜性表达(右侧),而肿瘤浸润的免疫细胞中多见胞质性表达(左侧)
Dako / Agilent 22C3 pharmDx PD-L1 IHC 检测

表1.膀胱癌PD-L1表达测定评估
针对非小细胞肺癌的PD-L1克隆抗体开展了许多一致性研究,其中PD-L1检测已在临床上实施多年,此类研究的数据表明,22C3,28,8和SP263用于检测肿瘤细胞染色具有高度一致性,而SP142试剂盒与其他相比敏感度偏低。
在UC中,对四种市售的、经过验证的PD-L1检测结果一致性进行研究,发现VENTANA SP263、PD-L1 IHC 22C3 pharmDx、PD-L1 IHC 28-8pharmDx的肿瘤细胞(TC)和免疫细胞(IC) PD-L1染色的分析结果具有良好的相关性。然而,患者PD-L1状态仅在VENTANA SP263和PD-L1 IHC 22C3 pharmDx之间达到一致。因此得出结论,UC患者在VENTANA SP263和PD-L1 IHC 22C3 pharmDx的一致性是相似的。当不同的PD-L1检测与指定的临床评分算法结合使用时,由于评分方式的实质差异,导致患者分类也会出现差异。
Hodgson等人研究了197例UC患者使用的3种PD-L1抗体试剂盒(Ventana SP263,Ventana SP142,Dako 22C3)和1种独立检测平台(Cell Signaling Technologies E1L3N)的一致性。[3]据报道22C3,SP142和SP263检测PD-L1存在高度一致性,只有12%的UC患者结果不一致。
Rijnders等人研究了139例肌层浸润性UC患者使用的4种PD-L1抗体试剂盒(Ventana SP263,Ventana SP142,Dako 22C3和Dako 28.8)和1种独立于平台的测试(Cell Signaling Technologies E1L3N),4种试剂盒之间有80-90%的一致性。另一项研究也考察了四种试剂盒的可比性,并记录了SP142在基于肿瘤细胞PD-L1评分中的异常染色行为。此外,本研究也强调了目前使用的评分算法和临界值之间的临床相关性。
此类研究的主要局限性是组织芯片的使用(妨碍对肿瘤异质性的评估),评估病理学家人数非常少(限制了观察者之间的可变性),缺乏分析一致性和算法一致性数据,缺乏前瞻性验证和响应数据。
2016年WHO对病理特征进行了完善,定义了UC的几种变异型。肿瘤以组织学变异为主要特征(即肿瘤样本中某些成分> 50%)的患者,除了小细胞神经内分泌癌具有明显的化疗敏感性外,通常表现出侵袭性的病程演变和对常规化疗的不良反应。
在Necchi等人的最新研究中,帕博利珠单抗辅助疗法用于组织学显著变异的鳞状细胞癌或淋巴上皮瘤样(LEL)特征的患者。研究结果,七名鳞状细胞癌患者中有六名(86%)下降至pT≤1,其中一个pT0和三例LEL变异中有两例pT0应答。相反,在其它UC组织变异型没有观察到病理学应答。[4]鳞状,肉瘤样和浆细胞样变异型比常规UC有更大的肿瘤内T细胞CD3浸润。有趣的是,肉瘤变异型相比巢状变异型,腺体变异型和常规UC表现出更显著的PD-L1高表达。此外,回顾性分析表明,鳞状细胞癌的CD274基因(编码PD-L1)扩增频率最高,中位TMB明显高于腺癌(p <0.001)。
UC基本上可以分为两种分子亚型,luminal型和基底型。两种亚型对目前的化学疗法和免疫疗法可能具有不同的敏感性。
全面的分子分析(例如高通量基因组分析)所需的技术非常昂贵,它不适用于常规诊断。有研究表明只有两种标记物即luminal蛋白(细胞角蛋白20)和基底蛋白(细胞角蛋白5/6)的免疫组化表达,足以准确识别UC的分子亚型,因此这一分子亚型在所有病理学实验室的日常实践中都有潜在的应用价值。
2017年4月, FDA基于II期试验IMvigor210-Cohort1的公布数据,批准Atezolizumab用于不适合顺铂治疗的局部晚期/转移性的尿路上皮癌。根据研究结果,及其他回顾性研究,PD-L1在肿瘤浸润免疫细胞中高表达(基底型60%VS. luminal23%)。PD-L1在肿瘤细胞中的高表达见于基底型(基底型39%VS.luminal型4%),与客观缓解率无关。
已有研究表明,与CD8+T-效应细胞相关的基因组与免疫细胞浸润高度相关,对atezolizumab有完全应答。在IMvigor210研究中,在luminal亚型中(II-TGCA组)观察到了更高的响应率,其特征在于存在活化的T效应细胞。基底簇III / IV也表现出免疫细胞PD-L1高表达以及CD8 +效应基因,包括肿瘤细胞上的PD-L1高表达。
为什么基底簇呈现出与luminal簇不同的反应速率的原因之一:可能是存在免疫抑制因子,通过抑制有效的T细胞活化来防止PD-L1 / PD-1通路的激活。
与缺乏响应有关的免疫抑制因子之一是成纤维细胞中的转化生长因子β(TGF-β)。Mariathasan等人表明,TGF-β受体信号的抑制增强了atezolizumab的能力,通过增加CD8+T细胞的数量来增强抗肿瘤免疫力。
肿瘤特异性抗原,即肿瘤抗原,是影响免疫治疗效率的重要因素。它们能区分肿瘤细胞与正常细胞,并刺激肿瘤特异性免疫反应。属于管腔型(luminal II-HER2-like型)的肿瘤具有高度肿瘤抗原负荷和肿瘤突变负荷(TMB),这与持久的免疫检查点抑制反应有关。
TMB也有一些不足之处。例如,测序试验之间很难标准化,TMB和治疗抗原负荷之间的关系仍然定义不清,并且无法评估免疫微环境的状态。

趋化因子和细胞因子的复杂相互作用对肿瘤微环境的炎症状态进行分类
(1)活化的T细胞和NK细胞释放干扰素-g (IFN-g),激活树突细胞和巨噬细胞中的STAT1、IDO-1(吲哚胺氧合酶I)和CMKLR1
(2)STAT1介导的信号转导和其他途径产生趋化因子CCL5和CXCL9
(3)通过CXCR6将其他T细胞引入肿瘤微环境。IFN-g刺激HLA分子和包括PSMB10在内的蛋白酶体成分的表达
(4)IFN-g上调T细胞上的PD-L1、PD-L2、TIGIT、lag3、B7-H3等免疫检查点分子
免疫基因表达谱的优点是,可以从单个样本中的多种细胞类型量化评估RNA,从而可以代表整个肿瘤微环境。除此之外,免疫表达谱还可以通过评估细胞因子,趋化因子以及细胞表面蛋白来精确量化特定肿瘤的炎症状态。
免疫基因表达谱也有一些缺点,特别是商业化的基因套餐缺乏标准化。
尽管特定的UC患者群需要进行PD-L1 IHC检测,但仅凭PD-L1对晚期UC中免疫检查点阻断的预测价值可能还不够。在过去的几十年中,使用人类样本和小鼠模型进行的转化研究已经研究了多种抗肿瘤免疫应答机制。在膀胱癌中,组织型变异和分子亚型与不同的免疫疗法/化疗的敏感性相关。另一方面,宿主特异性参数,如免疫浸润类型,活化和浸润水平,免疫基因表达谱,是需要评估的重要因素。未来的研究方向是根据现有的临床和转化数据,将这些因素纳入一个反应预测模型,并应用于临床实践。
许多可能预测免疫反应的临床和分子生物标记物正在研究中,包括肿瘤细胞和免疫细胞中的PD-L1表达,肿瘤突变负荷,基因表达谱特征定义的分子亚型以及宿主免疫系统的激活。所有这些潜在的生物标志物都受到技术问题的影响,例如可重复性,不同的评分算法,准确性,测试可靠性,动态变化,肿瘤异质性,采样变异性和缺乏标准化。然而,潜在的生物标志物的前瞻性验证和临床应用仍面临挑战。
正如Lovitch和Rodig所说“随着免疫治疗越来越复杂,并且与靶向药物结合使用,诊断病理学家将在识别和量化抗肿瘤免疫反应的细胞和分子生物标记物方面发挥越来越重要的作用。”
1.https://www.tandfonline.com/doi/full/10.1080/14712598.2020.1733965
2.Balar AV, Kulkarni GS, Uchio EM, et al. Keynote 057: phase II trial of Pembrolizumab (pembro) for patients (pts) with high-risk (HR) nonmuscle invasive bladder cancer (NMIBC)unresponsive to bacillus calmette-guérin (BCG). J Clin Oncol. 2019;37(7_suppl):350–350. DOI:10.1200/JCO.2019.37.7_suppl.350
3.Hodgson A, Slodkowska E, Jungbluth A, et al. PD-L1 immunohistochemistry assay concordance in urothelial carcinoma of the bladder and hypopharyngeal squamous cell carcinoma. Am J Surg Pathol. 2018;42(8):1059–1066.
4.Necchi A, Anichini A, Raggi D, et al. Pembrolizumab as neoadjuvant therapy before radical cystectomy in patients with muscle-invasive urothelial bladder carcinoma (PURE-01): an open-label, single-arm, phase II study. J Clin Oncol. 2018;36(34):3353–3360.






